Anorganické názvosloví

Obr. č. 1: Emil Votoček
Chemické názvosloví je univerzálním "jazykem chemiků", umělý jazyk s cílem vytvořit každé sloučeniny pokud možný jednoduchý a jednoznačný název. Chemické názvosloví má svou vlastní gramatiku, zásady a pravidla pro tvorbu vzorce i názvu a také má vlastní morfémy, což je kmen, předpony, přípony, lokanty.
Za nejdůmyslnější a nejdokonalejší chemické názvosloví na světě je považováno právě české chemické názvosloví. Emil Votoček je jeden z jeho nejvýznamnějších tvůrců.
Anorganická chemie je věda, která se zabývá vlastnostmi, složením a strukturou všech prvků a jejich sloučenin kromě většiny sloučenin uhlíku.
Chemické názvy téměř všech anorganických sloučenin se skládají ze dvou slov, z podstatného a přídavného jména. Podstatné jméno nám udává typ sloučeniny, například oxid, kyselina, sulfid atd. Od jakého prvku byla sloučenina odvozena, udává přídavné jméno.
Oxidační číslo
Oxidační číslo jakéhokoliv prvku je elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony v každé vazbě, které vycházejí z daného atomu, přidělili elektronegativnějšímu atomu.
Všechna oxidační čísla, s výjimkou nuly, se značí římskými číslicemi. Píšeme je jako horní index za značku prvku.
Oxidační čísla mohou nabývat kladných hodnot, záporných hodnot, ale mohou mít i hodnotu nula. Kladné hodnoty oxidačního čísla se pohybují v rozmezí od I+ do VIII+. Záporné hodnoty se pohybují v rozmezí od I- až do IV-.
U kladných oxidačních čísel se znaménko psát ani číst nemusí, ale my jej pro větší přehlednost píšeme. U záporných oxidačních čísel se znaménko bezpodmínečně píše i čte.
Oxidační čísla jednotlivých prvků můžete nalézt v periodické soustavě prvků.
Křížové pravidlo
K tomu, abychom vyjádřili oxidační číslo ve sloučeninách, které mají prvky v různém poměru, nám pomáhá křížové pravidlo:


Ovšem to neplatí vždy. Záleží na vzájemném poměru prvků. Jestliže máme například oxid wolframový WO3, křížovým pravidlem bychom určili, že vzorec oxidu wolframového je W2O6. Avšak poměr vázaných atomů musí být co nejmenší, proto se jejich počty vydělí co největším číslem tak, aby nám zůstala celá čísla:
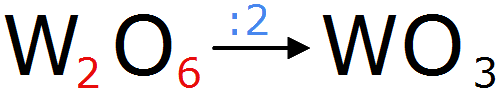
U solí, hydroxidů, hydrogensulfidů atd. využíváme toto pravidlo také, ovšem nikoliv mezi jednotlivými prvky, ale mezi celou kationtovou složkou a celou aniontovou složkou. Jestliže tedy máme fosforečnan vápenatý Ca3(PO4)2, křížové pravidlo se používá mezi vápenatým kationtem a fosforečnanovým aniontem:
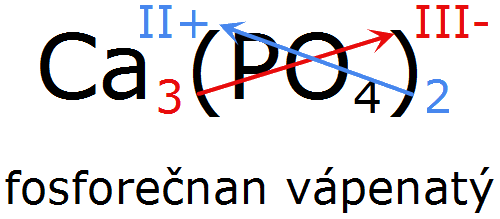
U komplexních sloučenin používáme křížové pravidlo také, i přesto, že se na první pohled zdá, že zde neplatí. Křížové pravidlo se v tomto případě používá mezi koordinační částicí a dalším prvkem:
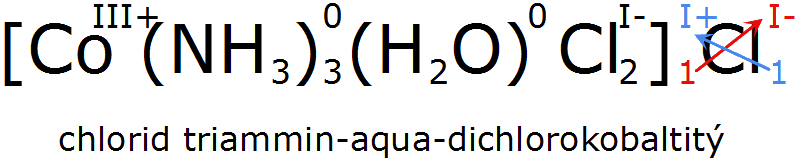
U křížového pravidla si můžeme také pomoci s periodickou soustavou prvků. Podle toho, v jaké skupině daný prvek leží, můžeme určit nejvyšší hodnotu oxidačního čísla, kterého může nabývat. Jestliže máme např. lithium, které leží v I.A skupině, jeho nejvyšší oxidační číslo je I+. Jestliže máme hliník, který leží v III.A skupině, jeho nejvyšší oxidační číslo je III+.
POZOR! Toto lze použít u A skupin. U B skupin pak záleží na elektronové konfiguraci, ne na čísle skupiny (i když to lze někdy pro určení oxidačního čísla také použít).
Elektronegativita
Schopnost atomů vázat elektrony chemické vazby se nazývá elektronegativita. Čím vyšší je, tím má atom větší potřebu elektrony vázat. Naopak atom s nízkou elektronegativitou elektrony rád "věnuje".
Nejnižší elektronegativitu má francium s hodnotou 0,7. Naproti tomu nejvyšší elektronegativitu má fluor s hodnotou téměř 4,0. Fluor má proto ve všech svých sloučeninách oxidační číslo I- (např. fluorid kyslíku OF2, kyselina fluorná HOF atd.).
Hodnotu elektronegativit jednotlivých prvků nalezneme v periodické soustavě prvků (pro pomoc slouží legenda).
Číslovkové předpony používané v chemickém názvosloví
Proto, abychom vyjádřili složení a strukturu sloučeniny v jejím názvu, používáme číslovkové předpony:
| 1/2 hemi- | 1 mono- | 2 di- | 3 tri- |
| 4 tetra- | 5 penta- | 6 hexa- | 7 hepta- |
| 8 okta- | 9 nona- | 10 deka- | 11 undeka- |
| 12 dodeka- | 13 trideka- | 14 tetradeka- | 15 pentadeka- atd. |
Pro vyjádření počtu složitějších víceatomových částic ve sloučenině se používají násobné číslovkové předpony:
| 2x - bis | 3x - tris | 4x - tetrakis | 5x - pentakis | 6x - hexakis atd. |
Název skupiny, který se nachází za násobnou předponou se v každém případě píše do závorky:
Přehled názvoslovných koncovek
| Oxidační číslo | Zakončení - kation | Zakončení - kyselina | Zakončení - sůl |
|---|---|---|---|
| I+ | -ný | -ná | -nan |
| II+ | -natý | -natá | -natan |
| III+ | -itý | -itá | -itan |
| IV+ | -ičitý | -ičitá | -ičitan |
| V+ | -ičný, -ečný | -ičná, -ečná | -ičnan, -ečnan |
| VI+ | -ový | -ová | -an |
| VII+ | -istý | -istá | -istan |
| VIII+ | -ičelý | -ičelá | -ičelan |